Sıkça Sorulan Sorular
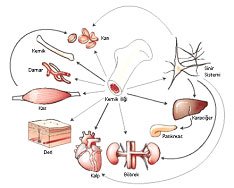
Farklı hücre tiplerine dönüşebilme potansiyeline ve kendisini yenileyebilme gücüne sahip olan hücrelere “kök hücre” deniyor.
Kök hücreler, vücudumuzdaki karaciğer, bağırsak ve cilt gibi organlarımızın hücrelerinden farklı olarak iki önemli özelliğe sahiptirler; Birincisi, bu hücreler uzun dönemler boyunca kendilerini yenilemek amacıyla bölünebilmektedirler. Oysa, yukarıda sayılan organlarımızın hücrelerinin bölünebilme kapasiteleri çok daha sınırlıdır. İkinci olarak, bir kök hücresinden elde edilen yavru hücre, birden fazla çeşit hücre tipine farklılaşabilmektedir. Örneğin, uygun deneysel veya fizyolojik şartlar altında bir kök hücre kalp kası hücreleri veya pankreasın insülin üreten hücreleri gibi özel işlevli hücrelere dönüşmek üzere uyarılabilirler. Oysa, vücudumuzdaki kas, cilt ve karaciğer hücreleri gibi hücrelerin belirli bir hedefi vardır ve bölündükleri zaman yine kendileri gibi bir hücre oluştururlar. Yani,karaciğer hücresi bölünmesiyle yeni bir karaciğer hücresi oluşuyor.


Kök hücreleri esas itibarıyle iki farklı kaynaktan elde edilirler: Embriyonik gelişimin erken evrelerinde (yaklaşık 5nci günde), embriyondan elde edilen kök hücreler. Bu şekilde elde edilen kök hücreler, tüp bebek merkezlerinde yapay döllenme yoluyla elde edilen embriyonlardan elde edilirler ve “Embriyonik Kök Hücreler” olarak isimlendirilir
Embriyonik olmayan kaynaklardan elde edilen kök hücreler. Erken embriyonik dönemden sonraki dönemlerde elde edilen kök hücreler 4 farklı kaynaktan temin edilebilir;
a) Kök hücreler, rahim içinde biraz büyüdükten sonra (yaklaşık 9ncu haftadan sonra) herhangi bir nedenden dolayı ölmüş fetüs’ ten (bu dönemdeki anne karnındaki canlıya verilen isim) elde edilebilir. Bu şekilde, düşük veya sonlandırılmış gebelik materyalinden elde edilmiş kök hücrelere “Fetüs Kök Hücresi” deniliyor.
b) Her yaştaki insanın çeşitli doku ve organlarında bulunan kök hücreler. Bu tür hücrelere “Erişkin Kök Hücresi” deniliyor.
c) Öldükten sonra belirli bir zaman içerisinde kadavradan elde edilen kök hücreler; “Kadavra Kök Hücreleri” olarak adlandırılmaktadır.
d) Doğum sonrası göbek kordonundan ve plasentadan elde edilen kök hücreler; sırasıyla “Göbek Kordonu Kök Hücreleri” ve “Plasenta Kök Hücreleri” olarak isimlendiriliyor.
İnsanoğlunun kök hücreler ile tanışıklığı 1960’lı yıllara kadar uzanmaktadır. O yıllarda kemik iliğimizde bulunan bir grup hücrenin kan sistemini oluşturan hücreleri yaptığının belirlenmesiyle, “kök hücre” terimi tıp terminalojisine girdi. Sonraları, kemik iliğindeki bu hücrelerin tüm kan sistemi hücrelerini (kırmızı ve beyaz kan hücreleri gibi) oluşturma yeteneğinden oldukça yararlanıldı. Önceleri, başta lösemiler olmak üzere birçok genetik kan hastalığının tedavisinde, bu hücrelerin sağlıklı bireylerden hastalara nakliyle (halk arasında “ilik nakli” olarak bilinir) başarılı sonuçlar elde edildi. Kemik iliği nakilleriyle kan yapıcı sistemin yenilenmesi protokolleri uygulanmaya devam ederken, aynı yapıdaki hücrelerin dolaşım sisteminde de varlığı saptandı. Bu kez,araştırmacılar periferik kandaki bu hücreleri daha fazla sayıda ve daha özgün şekilde elde etmenin yollarını aradılar. Sonuçta, “aferez” diye adlandırılan “hücre ayrıştırma” cihazlarıyla bu hücreleri uygun şekilde elde etmek ve nakil tedavilerinde (özellikle otolog) kullanmak mümkün oldu. Bu yöntem, daha az girişimsel teknikleri içermesi ve ekonomik olması gibi nedenlerle tercih edilmektedir. Sonraları, bu hücreler, çeşitli solit organları (akciğer, meme gibi) da içeren kanser olgularının teavisinde kullanılan yüksek dozdaki kemoterapi ve radyoterapi sonrası haraplanan kemik iliği kök hücrelerinin yenilenmesinde kullanılmaya başlandı. Buradaki amaç, hastalıklı hücreleri tamamen yok etmek amacıyla kullanılan yüksek dozdaki kemoterapi ve radyoterapi sonrasında zarar gören kemik iliği kök hücrelerinin yenilenmesini sağlamaktı.Bu gün ülkemizde ve tüm dünyada oldukça yaygın hale gelen bu işlemde, hastanın kemik iliği/periferik kan kök hücreleri tedaviye başlamadan önce toplanıyor, bir süre laboratuvar koşullarında korunuyor ve daha sonra tekrardan hastaya veriliyor. Böylece, tedavi sonrası kan yapıcı sistemin tekrar çalışması sağlanmış oluyor.
Plasenta; hem anneye hem da bebeğe ait dokular içeren ve gebelik süresince, bebek ile anne arasındaki besin ve gaz alışverişinin yapıldığı bir organdır. Anne karnındaki bebek; plasentaya göbek kordonu ile bağlıdır. Plasenta kanı olarak da bilinen “Göbek Kordon Kanı”, bebeğin anne karnında gelişirken gaz ve besin maddelerini anneden bebeğe; atık maddeleri, bebekten anneye taşıyan ve plasenta ile bebek arasında bağlantıyı sağlayan göbek kordonu içinde dolaşan kandır.
Son yıllarda, kan kök hücre kaynağı olarak göbek kordonundan elde edilen kan da kullanılmaktadır. 1980’li yılların başlarında bilim adamlarının yeni doğan bebeklerin kordon kanında da kemik iliğindekine benzer kök hücrelerinin bulunduğunu farketmeleri ile birlikte kordon kanından elde edilen bu hücrelerin belirli hastalıkların tedavisinde kullanılabileceği fikri ortaya çıktı. Göbek kordonu kanının, zengin bir kaynak olduğunun anlaşılması üzere 1988’den beri tedavi amaçlı kullanılmaya başlandı. 1988 yılında Fankoni aplastik anemi hastalığı bulunan bir çocuk ilk kez kordon kanı ile tedavi edildi.
Elde edilen kordon kanının belirli koşullar altında toplanıp dondurularak saklanabileceği ve daha sonra gerek duyulduğunda çözülerek kullanılabileceğini fark eden Dr. David Harris 1992 yılında oğlunun kordon kanını kendi laboratuvarında dondurarak sakladı. Daha sonra bu uygulamayı halka açması ile 1994 yılında dünyadaki ilk göbek kordonu kanı bankası ABD’de kurulmuş oldu. Takip eden yıllar içinde dünya üzerinde pek çok göbek kordonu kanı bankası kuruldu.
- Kemik iliği kök hücrelerine oranla sayıca az olmalarına rağmen çoğalım potansiyeli açısından daha güçlüdür.
- GVHD denilen verici hücrelerin alıcı hücrelerine karşı geliştirdiği ölümcül reaksiyonların görülme sıklığı daha azdır. Çünkü, GVHD reaksiyonlarından sorumlu bağışıklık sistemi hücreleri olan T-lenfositler yeni doğanda henüz tam olarak fonksiyonel değildir. Dolayısıyla, erişkin bir insanın kemik iliğinden elde edilen T-lenfositlere oranla GVHD reaksiyonu geliştirme potansiyeli daha azdır.
- Kemik iliği ve periferik kan kök hücre nakillerinde sıklıkla gözlenebilen ve ölümcül olabilen sitomegalovirüs (CMV) gibi viral enfeksiyonların geçiş riski daha azdır. Çünkü, bir çok virüs anneden bebeğe plasenta bariyeri denilen biyolojik (doğal) bir engel nedeniyle anneden bebeğe geçemez.
- Kan sistemini yeniden inşa etmek amacıyla yapılan nakillerde alıcı/verici arasında tam bir doku uyumu zorunlu değildir. Kemik iliği ve periferik kan kök hücre nakillerinde 6 da 6 uyumluluk söz konusuyken, kordon kanı kök hücre nakillerinde bu durum 6 da 4, hatta 6 da 3’e kadar kabul edilebilirdir.
- Radyasyon, yaşlanma, kimyasallar ve enfeksiyonlar gibi etkenler nedeniyle ister istemez zarar gören kemik iliği veya periferik kan kök hücrelerinin aksine kordon kanı kök hücreleri bu tür zararlı etmenlerle karşılaşmamıştır, yani daha genç ve sağlıklıdır.
- Kordon kanı kök hücrelerinin elde edilmesi, kemik iliği kök hücrelerinin elde edilmesinde olduğu gibi cerrahi girişim gerektirmez. Daha kolay bir işlemdir. Kordon kanı alımı sırasında anne veya bebek açısından hem risk hem de rahatsızlık vermesi söz konusu değildir.
- Nakil tedavileri için gereksinim olduğunda hızla elde edilebilir bir kaynaktır. Çünkü, kordon kanı alındıktan sonra gerekli testler yapılarak kullanıma hazır olarak saklanır.
- Kordon kanından elde edilebilen kök hücre sayısı, gelecekte 50 kg. vücut ağırlığına sahip bireylere kan sistemini yeniden inşa etmek amacıyla nakil tedavilerinde kullanılabilmektedir.
- Engrafman (kök hücrelerin alıcı kemik iliğine yerleşip kan yapımına başlaması) daha geç olur.
- Kemik iliği ve periferik kan kök hücreleriyle yapılan çalışmalara oranla kordon kanı kök hücreleriyle tedaviler oldukça yeni uygulamalardır, dolayısıyla deneyim sınırlıdır.
Yakın zamana kadar kordon kanı kök hücreleri miktar olarak daha az oranda elde edilebildikleri için çocuk hastalarda (50 kg.a kadar) kullanılırken son zamanlarda çoklu nakillerle (iki vericiden elde edilen kök hücrelerle) erişkinlerde de olumlu sonuçlar alınmaya başlanmıştır. Bunun yanında, kordon kanı kök hücrelerinin laboratuvar koşullarında çoğaltılmasıyla (ex vivo ekspansiyon) bu güçlüklerin üstesinden gelinmesi ve erişkin hastalar için de kolaylıkla kullanılabilir bir kaynak olması hedeflenmektedir. Bu amaçla, bir çok merkez çalışmalarına devam etmekte ve çok yakın bir gelecekte olumlu sonuçların alınması beklenmektedir.
Hayır. Yasal olarak kordon kanı saklanan bebek 18 yaşına kadar gelene kadar bu hücreler hakkında karar vericiler ebeveynlerdir. Şayet, bu dönemde aile içi gereksinim olursa bu hücreler kullanılabilir. Örneğin, 4 kardeşli bir ailede tam bir (6 da 6) doku uygunluk oranı % 25, altı kardeşli bir ailede % 90’dır. Tam uyumluluk yönünden anne/baba ile oran ise % 25’dir. Bunun yanında, nakil uygulamaları için kordon kanı kök hücrelerin tam bir doku uyumunun zorunlu olmadığı düşünülürse bu oranları daha da yukarı çekmek olasıdır. Dolayısıyla, kan sistemini yerine koymak amacıyla yapılacak olası tedavilerde aile içi bireyler (şimdilik 50 kg.a kadar olanlarda)’in gereksinimleri de kolaylıkla karşılanabilecektir.
Günümüzde kordon kanı ile tedavi edilebilen hastalıklardan bazıları şunlardır;
Akut lösemiler
Akut bifenotipik lösemi
Akut lenfoblastik lösemi
Akut myelojenik lösemi
Akut indiferansiye lösemi
Kronik Lösemiler
Kronik lenfositik lösemi
Kronik myelojenik lösemi
Jüvenil Kronik myelojenik lösemi
Jüvenil myelomonositik lösemi
Myelodisplastik sendromlar
Kronik myelomonositik lösemi
Refrakter anemi
Blastlarla birlikte refrakter anemi
Sideroblastlarla birlikte refrakter anemi
Kök Hücre bozuklukları
Fanconi anemisi, Paraksizmal nokturnal hemoglobinüri,Ağır aplastik anemi
Myeloproliferatif Bozukluklar
Akut myelofibro,Agnojenik myeloid metaplazi (Myelofibroz),Esansiyel trombositopeni
Polisitemia vera
Lenfoproliferatif Bozukluklar
Hodgkin Hastalığı, Non Nodgkin lenfoması
Prolenfositik lösemi
Fagosit bozuklukları
Chediak-Higashi sendromu,Kronik granülamatöz hastalık,Nötrofil aktin eksikliği,Retiküler disgenezi
Lipozomal depo hastalıkları
Adrenolökodistrofi,Gaucher hastalığı
Hunter sendromu,Hurler sendromu
Krabbe hastalığı,Maroteaux-Lamy hastalığı
Metakromatik lökodistrofi,,Morquio sendromu
Mukolipidoz II, Mukopolisakkoridozlar
Niemann Pick hastalığı,Sanflippo hastalığı
Schele sendromu,Sly sendromu, B-glukorinidaz eksikliği,Wolman hastalğı
Diğer Kanserler
Göğüs kanseri,Ewing sarkomu,Nöroblastom
Renal hücreli karsinom
Histiositik bozukluklar
Ailesel kritrofagositik lenfohistiositoz
Hemofagositoz, Histiositoz X
Kalıtsal eritrosit anormallikleri
Beta talesemi major,Saf kırmızı hücre aplazisi
Orak hücreli anemi
Konjenital(kalıtsal) bağışıklık sistemi bozuklukları
T ve B hücrelerinin yokluğu SCID
T hücrelerinin yokluğu normal B hücreleri SCID
Ataksia telenjiektazi, Bare lenfosit sendromu
Common varible immün yetmezlik,DiGeorge sendromu
Kostman sendromu,Lökosit adhezyon eksikliği
Omenn sendromu,Adenozin deaminaz eksikliği ile birlikte SCID,SCID(Ağır kombine immünyetmezlik hastalığı),Wiskott Aldrich sendromu
X’e bağlı lenfoproliferatif bozukluk
Diğer kalıtsal bozukluklar
Kıkırdak-saç hipoplazisi
Glanzmann trombastenisi
Lesh Nyhan sendromu
Osteopetrozis
Trombosit anomalileri
Amegakaryositoz
Konjenital trombositopeni
Plazma Hücresi Bozuklukları
Multipl miyeloma
Plazma hücresi lösemisi
Waldenstrm makroglobulinemi
Bugün için tedavisi mümkün görünmeyen hastalıkların birçoğu, yaşam için vazgeçilmez olan bazı hücre-doku ve organların, bir daha asla normal yapı ve işlevlerine döndürülmeyecek şekilde hasarlanmış olması sonucudur. Örneğin; tip I diyabet hastalığında pankreasta insülin salgılayan beta hücrelerinin, Parkinson hastalığında (titremelerle birlikte kas katılaşmalarıyla karakterize) beyinde dopamin salgılayan sinir hücrelerin hasarı söz konusudur. Bu tür hastalıkların bilinen tıbbi tedavi yöntemleriyle iyileştirilmesi bugün için mümkün değildir. Ancak, tip I diyabet hastaları yaşamlarını devam ettirebilmeleri için gerekli insülini dışarıdan alarak, kontrollü şekilde yaşamlarını sürdürürlerken, Parkinson hastaları yaşam kalitelerini arttırıcı bir takım tedavi protokolleri uygulamaktadır.
İşte, bu tür ve benzeri hastalıkların (Alzheimer, Multiple skleroz, ALS, Felçler, Otoimmün hastalıklar, Metabolik hastalıklar ve çeşitli kas hastalıkları gibi) kesin tedavisini sağlamak amacıyla araştırmacılar hasar gören hücre-doku veya organların biyolojik işlevlerini yerine koymak (rejeneratif tıp) ya da tamir etmek (reparatif tıp) ile mümkün olabileceğini düşünmüşler (örneğin, tip I diyabet için pankreasın adacık hücrelerinin yerine konması). Hücre esaslı tedavi, insanlardaki pek çok hastalık için bu şekilde bir tedavi stratejisi olarak ortaya çıkmıştır. Sonuçta, hedef doku veya organa, o organın işlevlerini eski haline getirmeye yetecek kadar sayıda ve kalitede izole edilmiş ve özellikleri belirlenmiş olan hücrelerin nakledilmesiyle bu amaca ulaşılabilir.
Son yıllarda, üzerinde en çok durulan kaynak “kök hücrelerin” vücutta veya laboratuvar koşullarında çoğaltılması esasına dayanan stratejilerdir. Çünkü, bir vücut hücresi sınırlı sayıda çoğalabilme kapasitesine sahipken, kök hücresi olarak adlandırılan hücreleri, laboratuvar koşullarında sınırsız sayıda çoğaltmak mümkün. Bunun yanında, bu tip hücrelerin adeta bir “bukelamun” gibi birçok çeşit hücreye dönüşebilme yeteneğinde olduklarının tespit edilmesiyle, hücre tabanlı tedavi protokolleri için önemli ilerlemeler sağlanmasına neden oldu.
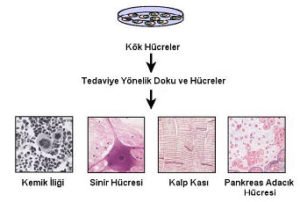
Bu gün dünyanın pek çok yerindeki laboratuvarlarda kök hücre teknolojileriyle hücre tabanlı tedavi protokollerinin klinik denemelerine geçilebilmesi için çok yoğun araştırmalar devam etmektedir. Bunun yanında, bazı hastalıklar için (örneğin Parkinson, ALS, Alzheimer, Felç ve Kalp rahatsızlıkları gibi) klinik uygulamalarına başlandı bile. İlk sonuçlar oldukça umut verici. Ayrıca, gen transferi teknolojileri kullanılarak kök hücre tabanlı tedavi yöntemleriyle birçok genetik kökenli hastalık için de ümit verici gelişmeler söz konusudur. Kök hücre teknolojileri kullanılarak halen klinikte kullanılan ya da üzerinde çalışılanan bazı hastalık grupları aşağıdaki tabloda belirtilmiştir.
| Hastalık | İşlev |
| Kanser | Hücrenin yerine konması
Tümörün ortadan kaldırılması Savaşçı hücrelerin üretilmesi |
| Parkinson
Ağrı Alzheimer ALS Omurilikte hasar Maküler bozunum | Transmiterin yerine konması
Faktör verilmesi Hücrenin yerine konması |
| Tip – 1 Diyabet | Sistemik insülin temini |
| Yanıklar | Hücrenin yerine konması
Doku üretilmesi |
| Karaciğer hastalıkları
(Viral hepatitler gibi) | Vücut dışı karaciğer desteği |
| Ülserler
Ayak pedi | Hücrenin yerine konması |
| Kıkırdak | Hücrenin yerine konması
Doku üretilmesi |
| Kalp – damar hastalıkları | Hücrenin temini yerine konması |
| Kas – Duchenne tipi atrofi | Hücrenin yerine konması |
| Kemik | Doku üretilmesi |
| Otoimmün hastalıklar
(Romatoit artrit, Crhonn, gibi) | Hücrenin yerine konması |
| Yaşlanmaya karşı
Anti-Aging (kozmetik amaçlı) | Hücrenin yerine konması |
| Down sendrom gibi genetik hastalıklar | Hücrenin yerine konması |
| Erkek ve dişi infertilitesi (kısırlık) | Sperm ve yumurta hücresi üretilmesi |
| Hormonal hastalıklar | Hücrenin yerine konması |
Gen tedavisinde hedef, hasta hücredeki veya organdaki bozukluğu hücrenin genetik yapısını değiştirerek düzeltmektir. Herhangi bir gen düzgün çalışmayınca kodladığı protein de normal yapıda olmamaktadır. Buna bağlı olarak vücutta çeşitli bozukluklar ve hastalıklar meydana gelir. Bozuk olan genin yerini alacak normal genin, hücrelere bir şekilde ulaştırılması gerekiyor. Bunun çeşitli yolları mevcuttur. Bunlardan ilki, gerekli gen veya genleri virüsler içerisine yerleştirerek vücuda vermektir. Birçok virüs hücre içerisine girdikten sonra genetik şifresini hücrenin genetik şifresine entegre ederek etkisini göstermektedir. Virüslerin bu özelliğinden yaralanılarak istediğimiz gen ve/veya genleri virüsler arcılığı ile hedef hücrelere transfer edebilmekteyiz. Şöyle ki, vücuda zarar vermesi engellenmiş olan virüslerin kendi genetik şifresi çıkartılarak istediğimiz geni transfer edebiliriz. Daha sonra bu virüsler kişiye damar yoluyla verilip belirli hücrelerin içerisine girmeleri sağlanıyor. Hücreye giren virüs, içerisindeki geni hedef hücrenin çekirdeğine aktarır ve hücrenin orijinal geni gibi görev yapmaya başlar.
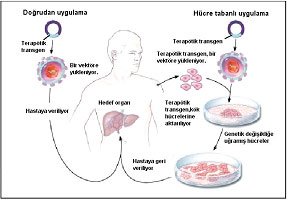
Son yıllarda hızlı bir ilerleme içersinde bulunan gen mühendisliği ve gen tedavisinde de kök hücrelerden faydalanılmaya başlandı. Halen ABD’de yapılan hücre programlanması ve gen tedavisi çalışmalarının üçte birinde, kök hücreler kullanılmaktadır. Vücut dışında programlanan kök hücrelerde birçok hastalığı tedavi etmek mümkündür. Kök hücrelerin en büyük avantajı, kendilerini sürekli olarak yenileyebilmeleridir. Böylece, programlanmış olan diğer hücreleri defalarca hastaya verilmesi yerine kök hücrelerinin bir kez verilmesi mümkün olmaktadır. Örneğin yukarıdaki şekilde de görüldüğü gibi, hastanın kan kök hücrelerine virüsler veya mikrokeseciklerle istenen gen yerleştirilir. Genetik yapısı değiştirilen kök hücreler kültürde çoğaltılır ve belli bir sayıya ulaştıktan sonra vücuda geri verilir. Programlanan kan kök hücreleri vücuda verildiğinde başta kemik iliği, karaciğer, dalak ve lenf düğümleri olmak üzere çeşitli organlara yerleşir ve işlevini görür.
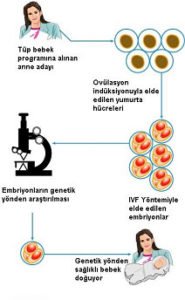
Döllenmiş yumurta hücresinin (zigotun) anne adayına nakli öncesinde, embriyonda yapılan preimplantasyon genetik çalışmalar özellikle tüp bebek (IVF-ICSI) uygulamalarının yaygınlaşmasıyla hızla artmıştır. Bu şekilde, daha öncesinde, sağlıksız bebek dünyaya getiren, ya da risk taşıyan aileler büyük oranda rahatlamışlardır. Erken embriyonik dönemde embriyonik hücrelerde çeşitli yöntemlerle yapılan genetik ve moleküler çalışmalar, o embriyonun gelecekte bazı hastalıklarla ilişkisini ortaya koyabilmektedir. Seçilmiş embriyo transferiyle genetik açıdan sağlıklı çocukların dünyaya gelmesi, aynı ailenin önceden doğmuş bazı genetik kökenli (talasemi gibi) ya da kan kökenli kanser hastalığına sahip çocukları içinde bir umut olmuştur. Bu konuda etik tartışmalar devam etmekle birlikte (bazı otörler abla/ağbisinin sağlık sorununu çözmek amacıyla bir çocuk dünyaya getirmeyi etik bulmamaktadırlar), bu tekniklerden yararlanılarak dünyaya gelen çocukların kordon kanı kök hücreleriyle ağbi/ablaları kesin olarak tedavi edilebilmektedir.
Embriyonik kök hücre çalışmalarının preimpantasyon tanı amacıyla başlamasını gösteren şematik çizim
29 Ağustos 2001 da ,15 embriyonda yapılan genetik incelemeler sonucu sağlıklı olduğuna karar verilen bir embriyonun annesinin rahmine transferi sonucunda Adam Nash isimli bir çocuk dünyaya geldi. Adam Nash’ın ablası Fankoni anemisi hastasıydı. Nash ise, pre-implantasyon genetik tanı yöntemleri kullanılarak Fankoni anemi geni taşımayan seçilmiş embriyon yardımlı üreme teknikleriyle anne rahmine yerleştirilmesi sonucu dünyaya geldi. Doğum sonrası elde edilen kordon kanı kök hücreleriyle ablası Molly tedavi edildi. Molly, şimdi oldukça sağlıklı bir şekilde yaşamına devam etmektedir. Bu dünyada gerçekleştirilen ilk uygulamaydı. Bundan sonra, başta talasemi olmak üzere bir çok hastalık için benzer uygulamalar yapıldı ve oldukça ümit verici sonuçlar alındı.
Embriyonik kök hücre çalışmalarının preimpantasyon tanı amacıyla başlamasını gösteren şematik çizim

29 Ağustos 2001 da ,15 embriyonda yapılan genetik incelemeler sonucu sağlıklı olduğuna karar verilen bir embriyonun annesinin rahmine transferi sonucunda Adam Nash isimli bir çocuk dünyaya geldi. Adam Nash’ın ablası Fankoni anemisi hastasıydı. Nash ise, pre-implantasyon genetik tanı yöntemleri kullanılarak Fankoni anemi geni taşımayan seçilmiş embriyon yardımlı üreme teknikleriyle anne rahmine yerleştirilmesi sonucu dünyaya geldi. Doğum sonrası elde edilen kordon kanı kök hücreleriyle ablası Molly tedavi edildi. Molly, şimdi oldukça sağlıklı bir şekilde yaşamına devam etmektedir. Bu dünyada gerçekleştirilen ilk uygulamaydı. Bundan sonra, başta talasemi olmak üzere bir çok hastalık için benzer uygulamalar yapıldı ve oldukça ümit verici sonuçlar alındı.
Embriyonik kök hücre çalışmalarının preimpantasyon tanı amacıyla başlamasını gösteren şematik çizim

2002 yılında İstanbul’da talasemi hastası 8 yaşındaki bir kız çocuğuna kardeşinin göbek kordonu kök hücreleri nakledildi. Yöntem kısaca şöyleydi : Talasemi hastası olan kız çocuğunun kan örnekleri alındı ve hastalığa neden olan 300 kadar farklı gen hatası tarandı. Sorumlu gen mutasyonu saptandı ve çift tüp bebek programına dahil edildi. Mikro enjeksiyon yöntemiyle yedi embriyon elde edildi. Embriyonlardan elde edilen birer hücrede genetik tarama yapıldı. Hücrelerin DNA’sı (genetik yapısı) önce PCR ile milyonlarca kez kopyalandı. Çoğaltılan bu genetik madde. “sequencer (gen dizi analizi)”cihazına aktarıldı. Embriyonlar hastalık açısından tarandı. Tarama sonucunda altısının sağlıksız, birinin ise sağlıklı olduğu anlaşıldı. Sağlıklı olan ve dokusu gelecekteki ablasına uyumlu olan embriyon anne rahmine transfer edildi. Gebelik oluştu. Gebeliğin 4. ayında amniyon sıvısından elde edilen fetüse ait hücrelerde yapılan incelemelerde doku uyumu ve hastalık taraması yapıldı. Durumun normal olduğu saptandı. Doğum sonrası göbek kordonundan 160 ml kan toplandı ve donduruldu. Daha sonra bu kandan kök hücreler ayrıştırılarak hastaya nakledildi.

Alınan kan, her doğumda ortalama 35-120 ml olmakla beraber, yapılan araştırmalar kan miktarı ne kadar çok ise -toplanacak kök hücre sayısını doğru orantılı olarak etkileyeceğinden- nakillerde o kadar başarılı sonuçlar alınabileceğini göstermiştir.
Kişi büyüdükçe vücut hacmi arttığından kordon kanındaki kök hücre sayısı ilk dondurulduğu şekli ve miktarı ile tedavide yetersiz kalmaktadır. Özel yöntemlerle miktarı arttırılmamış ise ihtiyaç duyulduğunda ortalama 45 kilograma kadar ağırlığa sahip bireylerde herhangi bir ek işlem gerektirmeden kullanılabilinir.
Ancak konu ile ilgili son gelişmeler sayesinde kordon kanındaki kök hücre sayısı laboratuvar ortamında arttırılabilmekte ve bu sayede 45 kilogramdan daha ağır olan erişkinlerde de kullanılabilmesi mümkün olmaktadır.
Bioarchive Sistemi özel kitleri sayesinde, daha sonradan asıl dondurma torbasına zarar vermeden hücre çoğaltımı için kullanılabilecek olan ek dondurma bölümleri içermektedir.

